Автор:
John Stephens
Дата создания:
27 Январь 2021
Дата обновления:
1 Июль 2024
Содержание
В химии, электроотрицательность единица измерения притяжения атома к электрону в химической связи. Атомы с высокой электроотрицательностью будут притягивать электроны с большой силой, тогда как атомы с низкой электроотрицательностью будут притягивать электроны со слабой силой. Значения электроотрицательности используются для прогнозирования способности образовывать химические связи между атомами, поэтому это важный навык в базовой химии.
Шаги
Метод 1 из 3: Базовые знания об электроотрицательности
Химическая связь возникает, когда атомы разделяют электроны. Чтобы понять электроотрицательность, вы должны сначала понять, что такое «связывание». Любые два атома, которые «соединены» вместе в молекулярной структуре, будут иметь связь между собой, а это означает, что они разделяют пару электронов, и каждый атом вносит один электрон в эту связь.
- Эта статья не раскрывает точную причину Почему атомы разделяют электроны и имеют связь между собой. Если вы хотите узнать больше, прочтите эту статью о химической связи или статью wikiHow о том, как изучать свойства химической связи.

Как электроотрицательность влияет на электроны в связи? Когда два атома связаны одной и той же электронной парой, эта доля не всегда находится в равновесии. Когда один атом имеет более высокую электроотрицательность, чем другой, он притягивает к себе два электрона в связи. Атом обладает очень высокой электроотрицательностью, которая может почти полностью притягивать к себе электроны и почти не делить электроны с другим атомом.- Например, в молекуле NaCl (хлорида натрия) атом хлора имеет относительно высокую электроотрицательность, а атом натрия - относительно низкую электроотрицательность. Следовательно, электроны тянутся к атому хлора а также вдали от атомов натрия.

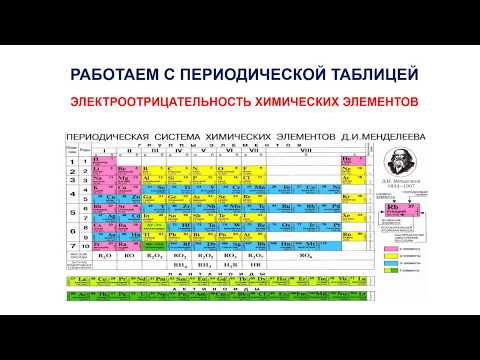
Для справки используйте таблицу электроотрицательности. В таблице электроотрицательности химические элементы расположены точно так же, как в периодической таблице, но электроотрицательность записана для каждого атома. Эта диаграмма напечатана во многих учебниках химии, технической литературе или в Интернете.- Это соединение, которое приводит к проверке электроотрицательности. Обратите внимание, что в этой таблице используется шкала Полинга, которая является наиболее распространенной шкалой электроотрицательности. Однако есть и другие способы измерения электроотрицательности, и один из них будет описан ниже.

Атомы расположены в порядке электроотрицательности для облегчения оценки. Если у вас нет диаграммы электроотрицательности, вы можете оценить электроотрицательность атома на основе его положения в обычной химической таблице Менделеева. Как общее правило:- Электроотрицательность атома постепенно выше когда вы идете дальше право периодическая таблица.
- Электроотрицательность атома постепенно выше как вы двигаетесь подниматься периодическая таблица.
- Следовательно, атомы в правом верхнем углу имеют самую высокую электроотрицательность, а атомы в левом нижнем углу - самую маленькую электроотрицательность.
- В приведенном выше примере NaCl вы можете сказать, что хлор имеет более высокую электроотрицательность, чем натрий, потому что он находится очень близко к правому верхнему углу периодической таблицы. Напротив, натрий находится далеко слева, поэтому он принадлежит к группе атомов с низкой электроотрицательностью.
Метод 2 из 3. Определите тип связи по электроотрицательности
Узнайте разницу электроотрицательностей между двумя атомами. Когда два атома связаны, разница в электроотрицательности между двумя атомами может сказать вам свойства этой связи. Вычтите низкую электроотрицательность для небольшой электроотрицательности, чтобы найти разницу.
- Взяв в качестве примера молекулу HF, мы вычтем электроотрицательность фтора (4,0) из электроотрицательности водорода (2,1). 4,0 - 2,1 = 1,9.
Если разность электроотрицательностей меньше примерно 0,5, то эта связь является неполярной ковалентной связью, в которой электроны распределены почти поровну. Этот тип связи не создает молекулу с большой разницей в заряде между концами связи. Неполярные связи часто трудно разорвать.
- Например, молекула O2 есть этот тип ссылки. Поскольку два атома кислорода имеют одинаковую электроотрицательность, их разница равна нулю.
Если разница электроотрицательности составляет 0,5–1,6, то связь является полярной ковалентной связью. Эти связи имеют больше электронов на одном конце, чем на другом. Это приводит к тому, что молекула имеет немного больший отрицательный заряд на конце электрона и немного больший чистый положительный заряд на другом конце. Неуравновешенность зарядов в связи позволяет молекуле участвовать в ряде особых реакций.
- Молекулярный H2О (вода) является ярким примером этого. Атом O имеет большую электроотрицательность, чем два атома H, поэтому он удерживает электроны более плотно и заставляет всю молекулу нести некоторый отрицательный заряд на конце O и часть положительно на конце H.
Если разность электроотрицательностей больше 2,0, то связь является ионной. В этой связи электроны целиком находятся на одном конце связи. Атомы с большей электроотрицательностью имеют отрицательный заряд, а атомы с меньшей электроотрицательностью имеют положительный заряд. Этот тип связи позволяет атому в нем хорошо реагировать с другими атомами и даже быть разделенным полярными атомами.
- Примером может служить молекула BaCl (хлорид натрия). У атома хлора такой большой отрицательный заряд, что он полностью притягивает к себе оба электрона, заставляя натрий заряжаться положительно.
Если разница электроотрицательности составляет 1,6–2,0, проверьте металлический элемент. Если имеют металлический элемент в связке - это связь ионы. Если металлических элементов нет - склейка полярный ковалентный.
- Металлические элементы включают большинство элементов слева и в середине таблицы Менделеева. На этой странице есть таблица, показывающая, какие элементы металлические.
- Приведенный выше пример HF находится в этом диапазоне. Поскольку H и F не являются металлами, они связаны полярный ковалентный.
Метод 3 из 3: Найдите электроотрицательность по Малликену
Найдите первую ионизирующую энергию атома. Электроотрицательность по Малликену - это метод измерения электроотрицательности, немного отличающийся от упомянутого выше метода шкалы Полинга. Чтобы найти электроотрицательность по Малликену для данного атома, найдите его первую ионизирующую энергию. Это энергия, необходимая атому, чтобы отдать электрон.
- Возможно, вам придется поискать это в своих химических справочниках. На этой странице представлена таблица поиска, которую вы можете использовать (прокрутите вниз, чтобы увидеть).
- Например, предположим, что нам нужно найти электроотрицательность лития (Li). Глядя на таблицу на предыдущей странице, мы видим, что первая энергия ионизации равна 520 кДж / моль.
Найдите электронное сродство атома. Это мера энергии, получаемой, когда атом получает электрон, чтобы сформировать отрицательный ион. Вы также должны найти этот параметр в своих химических справочниках. На этом сайте есть учебные ресурсы, которые вам следует искать.
- Электронное сродство лития 60 кДж моль.
Решите уравнение уровня электрического звука по Малликену. Когда вы используете кДж / моль в качестве энергии, уравнение электроотрицательности по Малликену имеет вид ENMulliken = (1,97 × 10) (Eя+ Eеа) + 0,19. Подставьте значения в уравнение и решите для ENMulliken.
- В этом примере мы решим следующее:
- ENMulliken = (1,97 × 10) (Eя+ Eеа) + 0,19
- ENMulliken = (1,97×10)(520 + 60) + 0,19
- ENMulliken = 1,143 + 0,19 = 1,333
- В этом примере мы решим следующее:
Совет
- Помимо шкал Полинга и Малликена, некоторые другие шкалы электроотрицательности - это шкалы Оллреда - Рохоу, Сандерсона и Аллена. У всех этих шкал есть свои уравнения для расчета электроотрицательности (довольно сложное число).
- Электроотрицательность нет единицы.