Автор:
Frank Hunt
Дата создания:
13 Март 2021
Дата обновления:
1 Июль 2024

Содержание
- Шагать
- Метод 1 из 3: Использование pH-метра
- Метод 2 из 3: лакмусовая бумага
- Метод 3 из 3: понимание pH
Важно измерить pH - степень кислотности или щелочности - воды. Воду используют растения и животные, от которых мы зависим, и мы пьем ее каждый день. Значение pH воды может указывать на возможное загрязнение, поэтому измерение pH воды может быть важной мерой предосторожности для общественного здравоохранения.
Шагать
Метод 1 из 3: Использование pH-метра
 Откалибруйте зонд и измеритель в соответствии с заводскими инструкциями. Возможно, вам потребуется откалибровать измеритель с использованием вещества с известным значением pH. Измеритель можно настроить в соответствии с этим веществом. Если вы собираетесь тестировать воду за пределами лаборатории, рекомендуется выполнить эту калибровку за несколько часов до полевых испытаний.
Откалибруйте зонд и измеритель в соответствии с заводскими инструкциями. Возможно, вам потребуется откалибровать измеритель с использованием вещества с известным значением pH. Измеритель можно настроить в соответствии с этим веществом. Если вы собираетесь тестировать воду за пределами лаборатории, рекомендуется выполнить эту калибровку за несколько часов до полевых испытаний. - Перед использованием промойте зонд чистой водой. Высушите чистой тканью.
 Возьмите пробу воды и перелейте ее в чистую емкость.
Возьмите пробу воды и перелейте ее в чистую емкость.- Вода должна быть достаточно глубокой, чтобы можно было погрузить кончик электрода.
- Оставьте образец на некоторое время, чтобы температура стабилизировалась.
- Измерьте температуру образца термометром.
 Отрегулируйте измеритель в соответствии с температурой образца. На чувствительность датчика влияет температура воды, поэтому измерение может быть точным только при вводе данных о температуре.
Отрегулируйте измеритель в соответствии с температурой образца. На чувствительность датчика влияет температура воды, поэтому измерение может быть точным только при вводе данных о температуре.  Поместите зонд в образец. Подождите, пока глюкометр достигнет равновесия. Глюкометр находится в стабильном состоянии, когда показания стабильны.
Поместите зонд в образец. Подождите, пока глюкометр достигнет равновесия. Глюкометр находится в стабильном состоянии, когда показания стабильны.  Считайте результат измерения pH образца. PH-метр показывает результат по шкале от 0 до 14. Если вода чистая, значение будет около 7. Запишите свои выводы.
Считайте результат измерения pH образца. PH-метр показывает результат по шкале от 0 до 14. Если вода чистая, значение будет около 7. Запишите свои выводы.
Метод 2 из 3: лакмусовая бумага
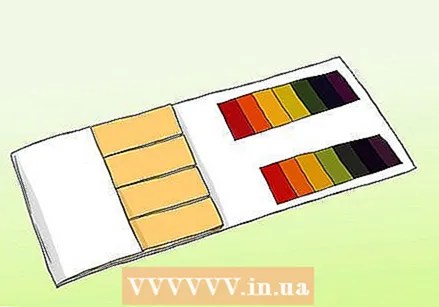 Узнайте разницу между pH-бумагой и лакмусовой бумажкой. Вы можете использовать pH-бумагу, чтобы получить точные показания образца. Тем не менее, pH-бумагу не следует путать с обычной лакмусовой бумажкой. Оба могут использоваться для проверки кислот и оснований, но они различаются по важным аспектам.
Узнайте разницу между pH-бумагой и лакмусовой бумажкой. Вы можете использовать pH-бумагу, чтобы получить точные показания образца. Тем не менее, pH-бумагу не следует путать с обычной лакмусовой бумажкой. Оба могут использоваться для проверки кислот и оснований, но они различаются по важным аспектам. - Полоски pH содержат серию индикаторных полосок, которые меняют цвет при воздействии раствора. Сила кислот и оснований на каждом батончике разная. После изменения цветовой узор можно сравнить с образцами, поставляемыми в комплекте.
- Лакмусовая бумага - это бумажная полоска, содержащая кислоту или основание (щелочь). Самые распространенные полосы - красные (с кислотой, которая реагирует с основаниями) и синяя (с основанием, которое реагирует с кислотами). Красные полосы становятся синими, если вещество является щелочным, а синие полосы становятся красными, если вещество является кислым. Лакмусовую бумагу можно использовать в качестве быстрого и легкого теста, но самые дешевые разновидности не всегда позволяют точно измерить концентрацию раствора.
 Возьмите пробу воды и вылейте ее в чистую емкость. Вода должна быть достаточно глубокой, чтобы на нее можно было погрузить полосу.
Возьмите пробу воды и вылейте ее в чистую емкость. Вода должна быть достаточно глубокой, чтобы на нее можно было погрузить полосу.  Окуните тест-полоску в образец. Достаточно выдержки в несколько секунд. Полоски индикатора на бумаге изменят цвет через несколько секунд.
Окуните тест-полоску в образец. Достаточно выдержки в несколько секунд. Полоски индикатора на бумаге изменят цвет через несколько секунд.  Сравните конец тест-полоски с таблицей цветов, прилагаемой к бумаге. Цвет или цвета на карточке должны совпадать с цветом или цветами тест-полоски. Затем цветовая карта связывает цветовые узоры с уровнями pH.
Сравните конец тест-полоски с таблицей цветов, прилагаемой к бумаге. Цвет или цвета на карточке должны совпадать с цветом или цветами тест-полоски. Затем цветовая карта связывает цветовые узоры с уровнями pH.
Метод 3 из 3: понимание pH
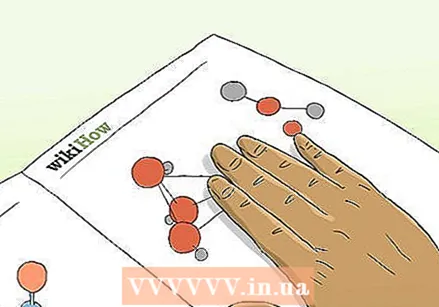 Узнайте, как определяются кислоты и основания. Кислотность и щелочность (термин, используемый для описания оснований) определяются ионами водорода, которые они отдают или поглощают. Кислота - это вещество, которое отдает (или «отдает») ионы водорода, а основание - это вещество, которое поглощает лишние ионы водорода.
Узнайте, как определяются кислоты и основания. Кислотность и щелочность (термин, используемый для описания оснований) определяются ионами водорода, которые они отдают или поглощают. Кислота - это вещество, которое отдает (или «отдает») ионы водорода, а основание - это вещество, которое поглощает лишние ионы водорода.  Изучите шкалу pH. Число pH используется для измерения степени кислотности или щелочности водорастворимых веществ. Вода обычно содержит одинаковое количество гидроксид-ионов (OH−) и ионов гидроксония (H3O +). Соотношение гидроксида и ионов гидроксония изменяется при добавлении в воду кислотного или щелочного вещества.
Изучите шкалу pH. Число pH используется для измерения степени кислотности или щелочности водорастворимых веществ. Вода обычно содержит одинаковое количество гидроксид-ионов (OH−) и ионов гидроксония (H3O +). Соотношение гидроксида и ионов гидроксония изменяется при добавлении в воду кислотного или щелочного вещества. - Обычно это шкала от 0 до 14 (хотя вещества вполне могут выходить за пределы этого диапазона). Нейтральные вещества получают около 7 баллов, кислые вещества - менее 7, а щелочные вещества - выше 7.
- Шкала pH является логарифмической, что означает, что целочисленные различия представляют десятикратную разницу в кислотности или щелочности. Например, вещество с pH 2 в десять раз более кислое, чем вещество с pH 3, и в 100 раз более кислое, чем вещество с pH 4. Шкала работает одинаково с щелочными веществами, с любыми целое число представляет собой десятикратную разницу.
 Узнайте, почему мы проверяем pH воды. Чистая вода имеет pH 7, но голландская водопроводная вода обычно имеет pH от 7,5 до 8,3. Очень кислая вода (вода с низким значением pH) с большей вероятностью растворяет токсичные химические вещества. Они могут загрязнить воду и сделать ее небезопасной для питья.
Узнайте, почему мы проверяем pH воды. Чистая вода имеет pH 7, но голландская водопроводная вода обычно имеет pH от 7,5 до 8,3. Очень кислая вода (вода с низким значением pH) с большей вероятностью растворяет токсичные химические вещества. Они могут загрязнить воду и сделать ее небезопасной для питья. - Как правило, рекомендуется проверять pH на месте. Если вы возьмете образец воды для лабораторных исследований, двуокись углерода (CO2) из воздуха может раствориться в воде. Растворенный диоксид углерода вступает в реакцию с ионами воды и увеличивает кислотность основных или нейтральных растворов. Чтобы избежать загрязнения углекислым газом, воду следует проверять в течение двух часов после сбора.